Un "GPS" diminuto para eliminar tumores con precisión
CIENCIAS DE LA SALUD Y TECNOLOGÍA.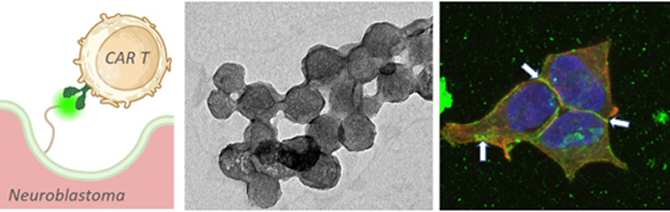
En los últimos años, el desarrollo de terapias basadas en la manipulación de células del sistema inmunitario con objeto de aumentar su capacidad de destruir células tumorales ha despertado un enorme interés.
Dentro de este tipo de terapias, una de las más prometedoras es la que utiliza linfocitos T (un tipo de glóbulo blanco especializado en la inmunidad celular) modificados genéticamente y conocidos como CAR T (por sus siglas en inglés, Chimeric Antigen Receptor T cells).
A la izquierda: esquema de unión de neuroblastoma marcado con fluoresceína con un CAR T. En el centro: imagen de microscopía electrónica de las protocélulas. A la derecha: imagen de microscopía confocal de fluorescencia de las células de neuroblastoma marcadas con fluoresceína (flechas blancas). Imágenes seleccionadas de ACS Appl. Mater. Interfaces 2025, 17, 8, 11937–11945
Los CAR T se producen a partir de células precursoras de linfocitos extraídas del propio paciente en las que se introducen modificaciones genéticas para dotarlas de la capacidad de detección de determinados patrones moleculares presentes únicamente en las células tumorales (antígenos tumorales).
De esta forma, cuando estos CAR T modificados se inyectan en el paciente, son capaces de buscar y destruir las células cancerosas de una forma extremadamente precisa y han demostrado una enorme eficacia para tratar ciertos cánceres de la sangre, como leucemias y linfomas.
Desafortunadamente, su eficacia en el tratamiento de tumores sólidos ha sido hasta el momento muy escasa. Una de las principales razones que explican esta baja eficacia es la incapacidad de los CAR T de reconocer a la célula tumoral dentro de un tejido tan complejo como suele ser un tumor sólido, donde habitan no solo las células tumorales, sino múltiples poblaciones celulares. Además, las células tumorales aprenden con el tiempo a ocultar sus antígenos superficiales dificultando aún más su reconocimiento por los CAR T.
Aquí es donde entran en juego unas nanopartículas inteligentes desarrolladas por un equipo de científicos integrado, entre otros, por Alejandro Baeza y Jorge Parra-Nieto de la Universidad Politécnica de Madrid (UPM), el Dr. Manuel Ramírez Orellana del Hospital Universitario Niño Jesús de Madrid, y el Dr. Javier García Castro del Instituto de Salud Carlos III (ISCIII), en España todas estas entidades.
Estas nanopartículas inteligentes (llamadas protocélulas, ya que presentan una composición similar a la de las células) son capaces de navegar por el torrente sanguíneo, acumularse preferentemente en la zona tumoral y, una vez allí, marcar selectivamente a las células tumorales con una determinada molécula (la fluoresceína) que es reconocida por los CAR T. En definitiva, las nanopartículas se comportan como un sistema de guiado para los CAR T ya que marcan con precisión a las células malignas y les muestran el camino a seguir, dejando a salvo a las células sanas.
En el trabajo realizado, se ha comprobado que el uso de estas nanopartículas mejora de forma significativa la capacidad de los CAR T para encontrar y eliminar selectivamente las células de un tipo de cáncer infantil muy agresivo que afecta al sistema nervioso y que actualmente no cuenta con tratamientos eficaces. Concretamente, se ha ensayado el uso de estas nanopartículas en modelos de neuroblastoma.
Actualmente, los investigadores están trabajando en la evaluación de la eficacia de estos sistemas en modelo de neuroblastoma en ratón, que imita de forma más precisa el tejido tumoral. Se espera que la información que se obtenga con estos ensayos permita estudiar su aplicación en humanos en un plazo de entre 2 y 5 años.
El estudio se titula “Liposomal-Based Nanoarchitectonics as Bispecific T Cell Engagers in Neuroblastoma Therapy. Y se ha publicado en la revista académica ACS Applied Materials & Interfaces. (Fuente: UPM)
Sitio Fuente: NCYT de Amazings